技术支持
如何使用DSC差示扫描量热仪测蛋白质热稳定性?
在药物开发中,差示扫描星热仪常用于药物筛选和优化过程,特别是在开发需要与特定蛋白质结合的化合物时。这种方法能够测量蛋白质在受热时的热行为,特别是在其结构发生变化时释放或吸收的热量。DSC能够提供有关蛋白质折叠和稳定性的重要信息,这对药物设计、生物技术和疾病研究等领域都是非常有价值的。通过比较未结合和已结合药物的蛋白质的DSC曲线,可以评估药物候选物如何影响蛋白质的热稳定性。
在生物制药领域,DSC常被用作一种品控方法,从而能够去确保胶原蛋白药物在整个生产存储过程中的一个稳定性和完整性。DSC方法不仅可以提供蛋白质热稳定性的信息,还可以帮助研究蛋白质折叠动力和二级结构。这是通过分析DSC曲线上面不同转变实现的,这些转变可能可能对应于 蛋白质不同结构或其他反应。
如何使用DSC差示扫描量热仪测蛋白质热稳定性?
1、测试设备:SC-DSC-D40差示扫描量热仪

2、操作步骤:
2.1 取制样品10-15mg 并放入坩埚称重
2.2 按照仪器的操作手册安装调节气体流量。
2.3 编写升温程序,以5'C/min 升温在70-90°范围内进行升温测试。
2.4 记录实验数据并分析结果。

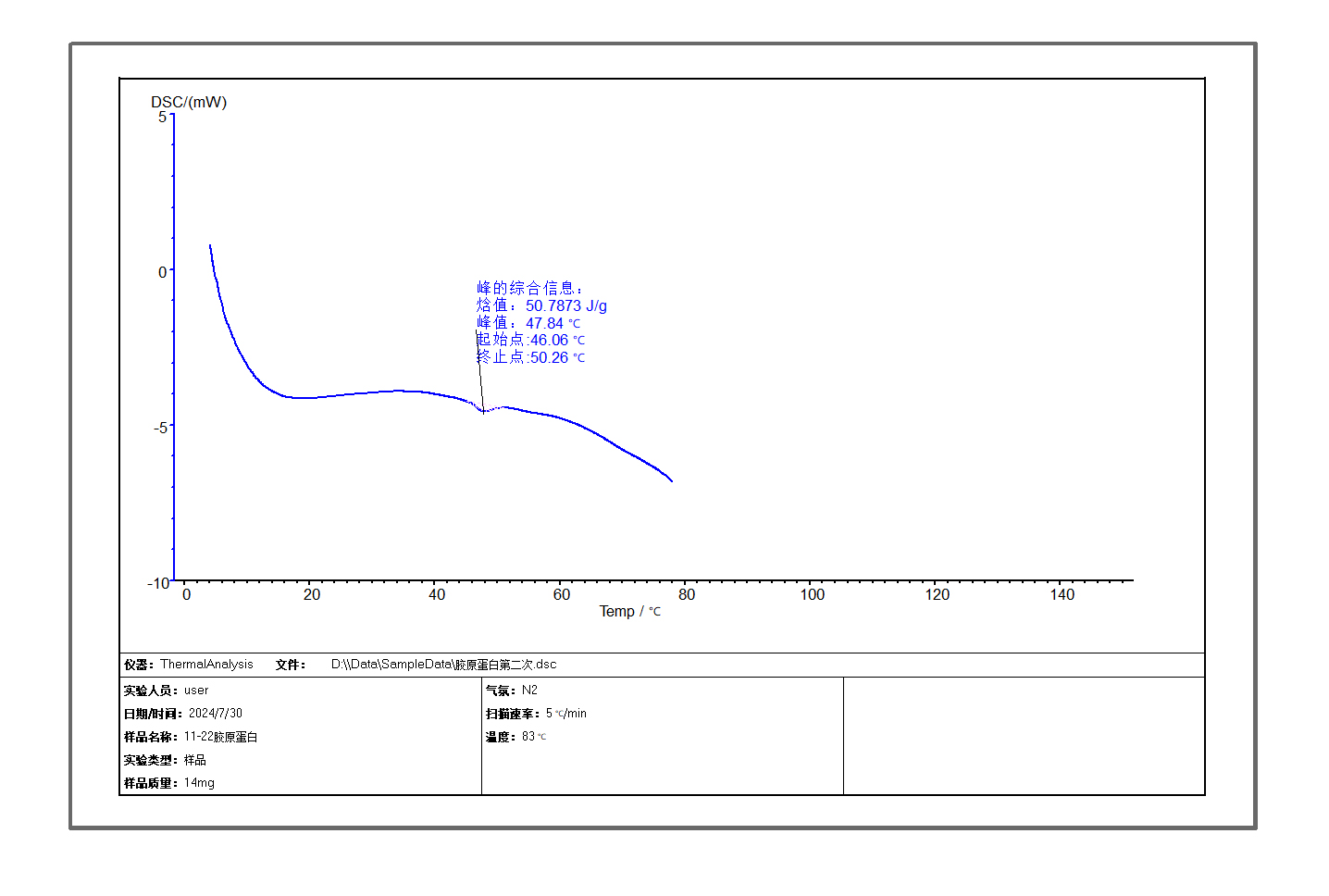
通过实验分析图谱所示,可以直接看出蛋白质的熔点(TM)46'℃及开始变性的一 个温度点,即稳定性被破坏。热焓值50J/g 对于蛋白质而言,这意味着用于使于蛋白质发生折叠所花费的总热量,代表一个吸热过程。由于蛋白质在 DSC 实验中暴露于升高的温度,因此蛋白质开始发生热变性,并伴随着非共价键的断裂。
通过此实验也可判断蛋白质是否失活。在 DSC 技术中,^Hcat仅由 DSC 热转变峰曲线积分的面积来确定,而 “Hvn仅通过热转变峰曲线的形状来确定。转变峰形越 尖锐,“HVH越大,反之亦然。使用-Hca/4Hvn可以帮我们估测是否有很大部分蛋白质是失活的。如果^Hcal显著低于AHVH,可以表明很大部分蛋白质已经失活。


